COMPLEJO MAYOR DE HISTOCOMPATIBILIDAD
Md. Rodney Macedo Gonzales
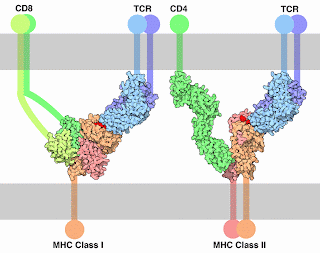
Como ya se vio anteriormente el Sistema Inmune Adaptativo tiene 2 tipos: el humoral y el celular, el primero por la acción de los Linfocitos B cuyo receptor de antígeno es el Anticuerpo (IgM e IgD), y el segundo mediante la acción de los Linfocitos T cuyo receptor el TCR (Receptor de Célula T) sólo reconoce secuencias peptídicas, por lo que necesita que alguien les presente el antígeno. Para cumplir esta función las APC (Células Presentadoras de Antígenos), procesan y mediante su MHC Tipo II presentan el Ag. El MHC no sólo cumple esta función, sino también identifica a cada uno, como un DNI; este MHC Tipo I, lo tienen todas las células nucleadas (incluyendo a las APC); y es de esta forma, como las Células del Sistema Inmune evalúan y verifican continuamente “si las células se encuentran sanas”.
DESCUBRIMIENTO
Durante la historia de la medicina surgió la idea de encontrar un método para reemplazar órganos que ya no funcionan, o para realizar combinaciones orgánicas quiméricas como sucede en el caso del Dios Ganesha o en la Obra Literaria Frankenstein. Pero en la práctica real no se podía realizar esto, debido a que el órgano o tejido trasplantado terminaba destruido. En el siglo XV se realizó el primer intento de transfusión sanguínea sin resultado positivo, y luego en el siglo XIX, Landsteiner identificó los tipos ABO y Rh sanguíneos, ya entonces nos dimos cuenta que no todos somos iguales. Por otro lado en el siglo XVI trasplantes de piel, nos enseñaron que los mejores resultados se daban entre hermanos gemelos o cuando se trataba de autotrasplantes. Para encontrar la explicación de esto en el año 1940 Snell estudió en ratones el rechazo de tumores, usando cepas endogámicas (grupo de ratones que luego de 20 generaciones tienen el mismo genoma: singénicos) demostró que éstas no rechazaban los tejidos recibidos, pero al usar ratones congénicos (que difieren en una región específica) existía rechazo. Se vio que hay dos grupos de regiones genómicas implicados en el rechazo de tejidos: el más importante o MHC (Complejo Mayor de Histocompatibilidad) y el Complejo Menor de Histocompatibilidad (compuesto por varias proteínas diferentes). Luego en el año 1960 y 1970 se descubrió que el MHC está implicado no sólo en el rechazo de tejidos, sino también en la presentación de antígenos, y son los que determinan que tan bien puede uno responder frente a un antígeno. Finalmente estos descubrimientos se convalidaron en el humano, de manera que los denominados HLA (Antígeno Leucocitario Humano) son productos proteicos de las secuencias incluidas en el MHC: HLA-A,HLA-B, HLA-C pertenecen al MHC I (o Intracelular) y HLA-DP, HLA-DQ, HLA-DR pertenecen al MHC II (o extracelular).
POLIMORFISMO GENÉTICO
Se denomina así cuando en la población se encuentra productos proteicos de un mismo gen o complejo genético que difieren entre individuo e individuo y que sirven para poder identificar a alguien (algo parecido a los microsatélites o fingerprintings, sólo que estos últimos no se expresan como productos proteicos son intrones). En el genoma humano la mayoría de proteínas expresadas no difieren mucho, es justo lo que permite que fenotípicamente seamos humanos, y no otra especie; a su vez existen otros grupos genéticos que determinan variantes de raza, o tamaño, tipo sanguíneo, etc. Pero estos no son tan diversos como lo que se observan en el MHC. Esto debido a que el MHC contiene secuencias polimórficas las cuales se encuentran en el denominado PBC o segmento de unión al antígeno. Es gracias a esta polimorfismo genético que la humanidad contiene la posibilidad de responder diferente frente a ciertos antígenos, imaginemos el caso de un patógeno muy agresivo al cuales sólo cierto tipo de MHC puede unirse adecuadamente, si todos tuviéramos los mismos MHC y no tuviéramos el denominado MHC, la población entera sucumbiría; en cambio al existir mayor polimorfismo los grupos humanos que sobrevivan tienen mayor defensa frente a organismos. Esta tendencia evolutiva a tener mayor diversidad de MHC se observa incluso en la atracción física, puesto que uno se siente más atraído por el olor de personas del sexo opuesto con MHC totalmente diferentes que hacia personas con el MHC parecido o igual (como a familiares).
.
HAPLOTIPO
Al conjunto de MHC (para el caso de las proteínas también se les denomina HLA) que cada individuo manifiesta en la superficie de sus células se le denomina Haplotipo. Este es el resultado de la combinación de los haplotipos de la madre y del padre en diferentes combinaciones para los hijos. Este haplotipo permite como ya vimos darnos nuestra exclusividad, de manera que para poder recibir un órgano donante debemos hacerlo de personas que tengan el haplotipo lo más parecido posible al nuestro para evitar rechazos. Es por eso que se realizan pruebas de compatilidad previamente a un transplante, asimismo existen bancos HLA donde se tiene información de los haplotipos de cada persona.
.
ORGANIZACIÓN GENÓMICA
En los humanos el MHC se encuentra en el cromosoma 6, pero la beta 2 microglobulina (componente del MHCI) se encuentra en el cromosoma 15. Ocupa un gran espacio del genoma: 3500 kb, y almacena secuencias no sólo de moléculas MHC (HLA) sino también de algunas citocinas y proteínas del complemento y del Shock Térmico. Este complejo se divide en tres segmentos: MHCII, MHCIII, MHCI.
MHC Tipo II
Se encuentra más pegado al extremo 5’del MHC y contiene todos los subtipos de moléculas del MHCII agrupadas en: HLA-DP, HLA-DQ, HLAD-DR. Contiene secuencias de proteínas implicadas en el procesamiento del antígeno como las proteínas TAP y TAP II, asimismo contiene moléculas del HLA-DM que interviene en la unión del antígeno al MHCII.
MHC Tipo I
Se encuentra en el extremo 3’ del MHC y contiene todos los subtipos de MHCI agrupadas en: HLA-A, HLA-B, HLA-C y otros HLA que cumplen diversas funciones como el HLA-G que está relacionado con la tolerancia que se observa en el embarazo.
MHC Tipo III
Se encuentra ubicado entre el MHCII y el MHCI y contiene genes de citocinas como el TNF y la Linfotoxina, genes de proteínas del complemento como: el Factor B, C2, C4B, y C4A. También contiene genes de HSP, que son proteínas que se expresan en situaciones de shock térmico.
ESTRUCTURA
Los MHC comparten características moleculares comunes: contienen una región intracelular, una región transmembrana, una región de dominios tipo Inmunoglobulina (por lo que pertenecen a la familia de las Superinmunoglobulinas) que puede ser reconocida por la molécula CD4 o CD8 dependiendo del caso, y una región de unión al antígeno o PBC. Este PBC es el contiene como ya se mencionó secuencias polimórficas reconocidas por el TCR (Restricción por el MHC).
MHC Tipo I
Esta molécula contiene 3 cadenas peptídicas, el esqueleto por decirlo de cierta forma la compone sólo una: la cadena alfa, esta contiene dominios alfa1 y alfa2 que componen el PBC, y el alfa3 (dominio tipo Ig) que se une al CD8. La otra cadena peptídica es una que no es codificada en el cromosoma del MHC: la beta 2 microglobulina, la cual cumple la función de estabilizar al MHC. Y la tercer cadena peptídica es el antígeno, que es una secuencia entre 8 y 11 aminoácidos.
MHC Tipo II
Esta molécula al igual que la anterior contiene 3 cadenas peptídicas, el esqueleto en este caso est;a compuesto por dos cadenas: la cadena alfa y la cadena beta, el PBC está compuesto por los dominios alfa1 y beta1, y el dominio beta 2 es la región reconocida por el CD4, el dominio alfa2 cumple una función estructural. El antígeno que se une en este caso es uno que tenga una secuencia de 15 a 30 aminoácidos, puesto que el PBC está compuesto por 2 cadenas y permite un mayor espacio.
UNIÓN DE PÉPTIDOS A MOLÉCULAS MHC
Los péptidos que se unen al MHC tienen residuos de aminoácidos (de anclaje) que pueden unirse a “bolsillos” que se encuentran en el PBC del MHC, es por esto que el MHC presenta cierta especificidad para el antígeno, pero con baja afinidad (la unión Ag-MHC es de menor afinidad que la unión Ag-TCR), es por esto que puede presentar diferentes Ag a diferentes clonas de TCR. El tamaño del antígeno importa, puesto que determina la fuerza con la que se une al PBC, esta unión es de tipo no covalente; también está determinada por la formación de enlaces de hidrógeno o mediante puentes salinos.
EXPRESIÓN DE MHC
El MHC I se expresa constitutivamente en todas las células nucleadas del cuerpo, éstas presentan constantemente Ag intracelulares (procesadas por el proteosoma); normalmente son antígenos propios, pero cuando hay infección viral o por bacteria intracelular, se presentan Ag extraños. Cuando el cuerpo humano sospecha de la presencia de infecciones intracelulares, puede liberar citocinas (Interferones y TNF: Factor de Necrosis Tumoral) que estimulan a las células para presentar mayor cantidad de MHC I. Las moléculas de MHC II se expresan en las APC (Macrófagos, Células Dendríticas y Linfocitos B) las cuales fagocitan y endocitan Ag extraños para presentarlos a los Linfocitos T CD4 (helper), los cuales pueden liberar citocinas que a su vez estimulan la expresión de mayor cantidad de MHC II.
rodney_macedo@hotmail.com




